
No existe una definición exacta de los seres vivos, ni tampoco una teoría que los englobe, de manera que se acotan sus propiedades. Éstas propiedades son las funciones vitales:
- Nutrición: Es la capacidad que tienen los seres vivos de tomar materia y energía del medio para realizar transformaciones mediante las reacciones químicas, y así producir materia propia para realizar las funciones. Ese conjunto de reacciones químicas de transformación se llama metabolismo. (Los virus no disponen de metabolismo)
 - La relación: Consiste en captar estímulos físico-químicos del medio y responder a ellos, normalmente a través del movimiento. Esta función permite realizar las funciones restantes, como la nutrición. Ambas funciones se realizan para asegurar nuestra propia supervivencia individual.
- La relación: Consiste en captar estímulos físico-químicos del medio y responder a ellos, normalmente a través del movimiento. Esta función permite realizar las funciones restantes, como la nutrición. Ambas funciones se realizan para asegurar nuestra propia supervivencia individual.
- La reproducción: Es la capacidad de producir descendencia semejante a nosotros. A diferencia de la función de nutrición y de relación, la reproducción no la realizamos por nosotros mismos, sino para la perpetuación de la especie.
 El 60% de nuestro consumo energético va destinado a esta función, y no es para la supervivencia individual, de modo que es un comportamiento altruísta, desinteresado por el bien propio y gratuito porque no ganamos nada al reproducirnos.
El 60% de nuestro consumo energético va destinado a esta función, y no es para la supervivencia individual, de modo que es un comportamiento altruísta, desinteresado por el bien propio y gratuito porque no ganamos nada al reproducirnos.
Es una función que se realiza por el bien de la especie.
 El 60% de nuestro consumo energético va destinado a esta función, y no es para la supervivencia individual, de modo que es un comportamiento altruísta, desinteresado por el bien propio y gratuito porque no ganamos nada al reproducirnos.
El 60% de nuestro consumo energético va destinado a esta función, y no es para la supervivencia individual, de modo que es un comportamiento altruísta, desinteresado por el bien propio y gratuito porque no ganamos nada al reproducirnos.Es una función que se realiza por el bien de la especie.
Todas estas funciones que realizamos los seres vivos nos proporcionan autonomía y nos hace ser autosuficientes, valiendonos así por nosotros mismos.
Los virus, sin metabolismo, no son autónomos porque no tienen funciones de nutrición ni de relación, por lo tanto están destinados a ser parásitos obligados, ya que necesitan entrar en células para utilizar su metabolismo para reproducirse. Sólo tienen función de relación para atacar a otras células.
Los virus, sin metabolismo, no son autónomos porque no tienen funciones de nutrición ni de relación, por lo tanto están destinados a ser parásitos obligados, ya que necesitan entrar en células para utilizar su metabolismo para reproducirse. Sólo tienen función de relación para atacar a otras células.
1.1 Niveles de organización de los seres vivos.
Estamos hechos de materia, pero hay una propiedad de la materia que dice que bajo ciertas circunstancias tiende a aumentar su complejidad y organización. Todo el universo material se caracteriza porque está formado por unos niveles de organización o complejidad en los que se incluyen unos dentro de otros. El primer nivel de organización en el universo material son las partículas elementales subatómicas, que son los electrones y quanks, de donde salen los protones y electrones. Estas partículas se unen formando átomos.Un átomo es la parte más pequeña a dividir la materia que conserva las propiedades de ésta. No se presentan aislados (excepto los gases nobles) y su unión forma moléculas. Las moléculas son una serie de átomos enlazados y pueden ser amorfas o cristalinas. Su asociación forma macromoléculas. Pueden estar formadas por millones de moléculas, como el ADN. No se encuentran aisladas sino que se asocian formando complejos supramoleculares. Un complejo supramolecular puede ser ADN más una proteína, formando nucleoproteínas, o un virus. Estos complejos supramoleculares se asocian formando orgánulos celulares, dando lugar, por ejemplo, a un ribosoma.
Hasta aquí son los niveles de organización del universo abiótico, de los seres inertes. La asociación de orgánulos celulares constituyen a una célula, que tiene la suficiente complejidad para tener autonomía y podemos encontrarnos dos tipos: eucariotas y procariotas. La unión de células forman organismos, que pueden ser organismos unicelulares o pluricelulares. En los organismos pluricelulares primitivos sin tejidos todas las células son iguales como las esponjas, hongos, algas... Los organismos pluricelulares con tejidos tienen células especializadas con la misma estructura y la misma función. La asociación de tejidos con el fin de desempeñar una función forman órganos, como el tejido epitelial, tejido nervioso y el tejido secretor para la digestión gástrica en el estómago. Las asociación de órganos con el fin de desempeñar una función forman aparatos, como el aparato digestivo. Sin embargo, un sistema está formado por un mismo órgano distribuido por todo el organismo con una misma función, como el sistema esquelético donde el órgano es el hueso.
Hasta aquí llegan los niveles de organización a nivel de organismo. Sin embargo podemos seguir organizando niveles. Al conjunto de organismos de la misma especie en el mismo tiempo y en el mismo sitio se le denomina población, donde se dan interacciones intraespecíficas, como competiciones, familias, rebaños, bandadas, sociedades... Al conjunto de todas las especies que viven en el mismo tiempo y en el mismo lugar se le denomina comunidad, donde se dan interacciones interespecíficas, que son relaciones entre diferentes especies como el parasitismo, la depredación... Esto permite el ciclo de la materia, es decir, el flujo de energía en el ecosistema. Una comunidad también se relaciona con el medio físico (biotopo) y forma un ecosistema. El conjunto de los ecosistemas es la biosfera.
Esta complejidad que incluye una organización dentro de otra existe para permitir la división de trabajo y además permite hacer varias cosas al mismo tiempo, ya que hay aparatos especializados. Esta división aumenta la eficacia biológica, la cual quiere decir que podemos funcionar con menos materia y energía. Es evidente que no se puede afectar a un nivel únicamente sin afectar a otros debido a su forma de organización.
2. COMPOSICIÓN MOLECULAR DE LOS SERES VIVOS: BIOELEMENTOS Y OLIGOELEMENTOS
Si se hace un análisis químico vemos que todos los seres vivos tienen la misma composición cualitativa y cuantitativa muy semejante. No corresponde la composición de los seres vivos con la composición química de la corteza ni del planeta, por lo tanto los elementos de la composición de los seres vivos no lo son por azar ni por abundancia. De manera que los elementos químicos de los seres vivos tienen las propiedades adecuadas que ellos necesitan (propiedades vitales).
Hay dos tipos de elementos que forman los seres vivos y entre todos forman unos 70 de los cuales únicamente 16 son comunes entre todos los seres vivos. Estos elementos están agrupados en la tabla periódica porque tienen propiedades similares:
1.- Todos los elementos tienen baja masa atómica, es decir, son los más ligeros con la finalidad de que el peso atómico es inversamente proporcional a la estabilidad del enlace covalente. Este enlace es el más característico de la materia viva y nos obliga a recordar la teoría del enlace, que explica el por qué se forman. Los gases nobles son los átomos más estables y no forman enlaces porque tienen su última capa de electrones completa lo que les permite una máxima estabilidad y no necesitan unirse. Los demás elementos no son estables porque tienen su última capa de electrones incompleta y necesitan unirse con otros átomos (formar enlaces) para llegar a ser estables. Para formar enlaces se dan dos tipos de situaciones. En primer lugar, a un átomo le sobran o le faltan pocos electrones para completar su última capa entonces ganan o pierden electrones. No necesitan energía para formarse. Es el caso de los enlaces iónicos.
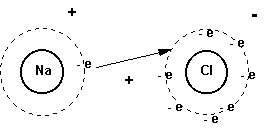
Cloruro de sodio: Al sodio le sobra 1 electrón para ser
estable que cede al cloro, ya que al cloro le falta
un electrón para ser estable.
La segunda situación se da cuando los elementos tienen que perder o ganas demasiados electrones, entonces los comparten. Es el caso de los enlaces covalentes.

Metano: al carbono le sobran cuatro electrones y
a cada uno de los cuatro hidrógenos les
sobra un electrón, entonces son compartidos,
llegando a la totalidad de ocho electrones,
cumpliendo la teoría del octeto y siendo estables.
Este es el enlace de los seres vivos. Necesitan energía para que se formen enlaces covalentes, de manera que hay que obligarlos a que se unan.
2.- El bajo peso atómico · El calor específico = constante (6,3). Si tiene bajo peso atómico, tiene un alto calor específico. El calor específico es la cantidad de calor necesario para aumentar la temperatura de un gramo de una sustancia un grado centígrado. Como los elementos químicos de los seres vivos tienen un alto calor específico, necesitan mucho calor o energía para calentarse muy poco. De igual manera, necesitan una temperatura muy baja para enfriarse muy poco. Por lo tanto, gracias a este calor específico alto los seres vivos son capaces de amortiguar los grandes cambios de temperatura. Si lo vemos desde el punto de vista del metabolismo, que son reacciones químicas las cuales algunas de ellas liberan energía, y si no tuviésemos ese calor específico tan alto, el metabolismo nos elevaría muchísimo la temperatura y estaríamos expuestos a sobrecalentamientos mortales.
3. - Iones monovalentes: Son átomos que tienen una carga eléctrica (K+, Na+, Cl-...) y poseen además otra propiedad, y es que son solubles en agua. Ambas permiten que las utilicemos para el control de los gradientes eléctricos o químicos. Un gradiente es una variable que varía a lo largo de una línea. Los gradientes eléctricos son inevitables para la contracción muscular o el impulso nervioso y son debidos tanto a iones monovalentes como a los gradientes químicos. La presión osmótica posee gradientes. Se da debido a un soluto y el gradiente empuja al soluto y al disolvente hasta tener la misma concentración, esto se llama difusión. La difusión es el principal transporte de los seres vivos y se da gracias al gradiente electroquímico.
4.- Iones divalentes: Como Ca++, Mg++, Mn++, Co++, Fe++... Son metales pesados divalentes a los cuales les faltan dos electrones y les resulta muy sencillo aceptar y/o desprender un electrón. Hay muchas reacciones químicas del metabolismo en las que se suelta un electrón, son las llamadas reacciones redox. También se encuentran en las cadenas transportadoras de electrones que recogen estos iones divalentes, aceptan esos electrones. Estas reacciones forman parte de la respiración celular y la fotosíntesis.
5.- C,H,O,N: Forman el 95% de todos los seres vivos. Son elementos cuya electronegatividad es muy diferente, de manera que si se combinan siendo uno más electronegativo que otro, como el hidrógeno y el oxígeno, los electrones quedan asimétricamente distribuidos quedándose el oxígeno con cierta carga negativa y el hidrógeno cierta carga positiva. Este es un tipo de enlace covalente dativo (agua H2O). Es una molécula polar, como casi todas las sustancias que forman a los seres vivos porque se tienen que llevar bien con el agua. El carbono y el nitrógeno, lo mismo se oxidan que se reducen con facilidad y se combinan tanto con el oxígeno como con el hidrógeno.
El carbono es un átomo extraordinario:
- En su última capa tiene cuatro electrones y le permite formar hasta cuatro enlaces covalentes consigo mismo y con la mayoría de los elementos de los seres vivos.
- Como tiene un bajo peso atómico, cuando forma enlaces consigo mismo, son muy estables con lo cual no se rompen con facilidad. Por eso las cadenas de carbono constituyen el esqueleto de las moléculas orgánicas. Son tan estables que permiten hacer cadenas muy largas y lineales, además de formar anillos de seis y cinco eslabones.

Polietileno
- Forma estructuras en tres dimensiones, es decir, tienen una forma una espacial (tetraédrica) donde el carbono se encuentra en el centro.

Si se suman sus propiedades, se pueden hacer moléculas diferentes de carbono infinitas con la finalidad de realizar infinitas funciones distintas. Siendo el carbono sólo el 1% de la corteza, constituye el 18% en las moléculas orgánicas.
Otro átomo es el silicio y también puede formar cuatro enlaces covalentes, pero tiene una limitación y es que los enlaces que forman se rompen con facilidad porque tiene un peso atómico mayor. Entre el oxígeno y el silicio las moléculas sí son estables, lo que pasa es que las moléculas son inertes por su gran estabilidad, como las siliconas. Esto los hace inútiles para los seres vivos. El silicio es el 35% del planeta, con lo cual nos conduce a una idea, y es que las moléculas orgánicas deben ser suficientemente estables para no romperse con facilidad pero también tienen que ser suficientemente inestables para transformarse durante el metabolismo, para reaccionar fácilmente químicamente.
Los elementos químicos de la vida se dividen en:
- Bioelementos: Son aquellos que se encuentran a más del 0,1%, como el sodio, potasio, cloro, fósforo... o el carbono, hidrógeno, oxígeno, y nitrógeno, que se encuentran al 95%.
Los bioelementos siempre están presentes, pero los oligoelementos varían según la especie, ya que se han encontrado hasta 60 elementos diferentes. Solo existen 14 elementos comunes a todos los seres vivos (Fe, Cu, Mg, Co...) y se encuentran en cantidades tan pequeñas que a veces resulta difícil saber qué función cumple en los seres vivos. Sin embargo son esenciales y su carencia supone una enfermedad al ser vivo, así como su exceso también puede ser perjudicial. Forman parte de la vida porque desempeñan funciones esenciales e importantes, como el yodo, que es necesario para la fabricación de la hormona tiroidea y su falta produce una enfermedad llamada bocio. El hierro es necesario para la hemoglobina en sangre (molécula del oxígeno) y el flúor necesario para el esmalte dental.
3. CARACTERÍSTICAS DE LAS BIOMOLÉCULAS
Las biomoléculas son las moléculas de los seres vivos. El 70% de los seres vivos es agua y el resto (30%) es peso seco. El 95% del peso seco son moléculas orgánicas, razón por la que se dice que los seres vivos están compuestos por materia orgánica. El 5% restante son sales minerales. Existen entonces biomoléculas inorgánicas (H2O, sales, gases) y biomoléculas orgánicas (glúcidos, lípidos, proteínas y ácidos nucleicos) Como características de las biomoléculas orgánicas encontramos que son macromoléculas: Es decir, muy grandes. ¿Cómo lo hacen para ser tan grandes? Como los ácidos nucleicos, con miles de millones de nucleótidos o las proteínas. La solución es porque son poliméricas: Una molécula grande formada por otras más pequeñas llamadas monómeros, que se repiten. Por ejemplo, las proteínas están formadas de aminoácidos, éstos de nucleótidos, éstos de glúcidos, y éstos de monosacáridos. Los lípidos de ácidos grasos y alcohol... pero no todas son iguales. Entre los polímeros orgánicos hay dos tipos: Polímeros de monómeros iguales como los glúcidos (almidón y celulosa) y los lípidos; Y los polímeros de monómeros diferentes como las proteínas con 20 amonoácidos distintos y los ácidos nucleicos con cuatro nucleótidos distintos.
 Esto tiene consecuencias importantes como para determinar la función que realizan. Por ejemplo, los polímeros de monómeros iguales sirven como almacenamiento (como los polisacáridos: almidón y grasa) y de fuente de energía (como los monosacáridos y los ácidos grasos). Un polímero de monómeros iguales sirve para construir estructuras (función estructural) como la celulosa que forma la estructura de la pared celular o los fosfolípidos que forma la membrana celular.
Esto tiene consecuencias importantes como para determinar la función que realizan. Por ejemplo, los polímeros de monómeros iguales sirven como almacenamiento (como los polisacáridos: almidón y grasa) y de fuente de energía (como los monosacáridos y los ácidos grasos). Un polímero de monómeros iguales sirve para construir estructuras (función estructural) como la celulosa que forma la estructura de la pared celular o los fosfolípidos que forma la membrana celular.
 Estas son funciones pasivas, no hacen nada, simplemente están ahí. Sin embargo, los polímeros de monómeros diferentes, como los ácidos nucleicos y las proteínas, tienen una propiedad extra y es que tienen la capacidad para hacer muchas cosas. Esto se debe a que están compuestos por monómeros diferentes, entonces sus moléculas tienen un orden, una secuencia que le permite contener una información y si se corta y se vuelve a unir, la molécula ya no es la misma, por lo tanto, ya no contiene la misma información. Los ácidos nucleicos tienen la información genética y esta es una secuencia de nucleótidos. Las proteínas también tienen información y es su secuencia de amonoácidos, que determina la forma de la proteína y esta forma determina su función. Estas son funciones activas, que actúan y hacen cosas a diferencia de las funciones pasivas de polímeros de monómeros iguales.
Estas son funciones pasivas, no hacen nada, simplemente están ahí. Sin embargo, los polímeros de monómeros diferentes, como los ácidos nucleicos y las proteínas, tienen una propiedad extra y es que tienen la capacidad para hacer muchas cosas. Esto se debe a que están compuestos por monómeros diferentes, entonces sus moléculas tienen un orden, una secuencia que le permite contener una información y si se corta y se vuelve a unir, la molécula ya no es la misma, por lo tanto, ya no contiene la misma información. Los ácidos nucleicos tienen la información genética y esta es una secuencia de nucleótidos. Las proteínas también tienen información y es su secuencia de amonoácidos, que determina la forma de la proteína y esta forma determina su función. Estas son funciones activas, que actúan y hacen cosas a diferencia de las funciones pasivas de polímeros de monómeros iguales.

4. EL AGUA
 Esto tiene consecuencias importantes como para determinar la función que realizan. Por ejemplo, los polímeros de monómeros iguales sirven como almacenamiento (como los polisacáridos: almidón y grasa) y de fuente de energía (como los monosacáridos y los ácidos grasos). Un polímero de monómeros iguales sirve para construir estructuras (función estructural) como la celulosa que forma la estructura de la pared celular o los fosfolípidos que forma la membrana celular.
Esto tiene consecuencias importantes como para determinar la función que realizan. Por ejemplo, los polímeros de monómeros iguales sirven como almacenamiento (como los polisacáridos: almidón y grasa) y de fuente de energía (como los monosacáridos y los ácidos grasos). Un polímero de monómeros iguales sirve para construir estructuras (función estructural) como la celulosa que forma la estructura de la pared celular o los fosfolípidos que forma la membrana celular.  Estas son funciones pasivas, no hacen nada, simplemente están ahí. Sin embargo, los polímeros de monómeros diferentes, como los ácidos nucleicos y las proteínas, tienen una propiedad extra y es que tienen la capacidad para hacer muchas cosas. Esto se debe a que están compuestos por monómeros diferentes, entonces sus moléculas tienen un orden, una secuencia que le permite contener una información y si se corta y se vuelve a unir, la molécula ya no es la misma, por lo tanto, ya no contiene la misma información. Los ácidos nucleicos tienen la información genética y esta es una secuencia de nucleótidos. Las proteínas también tienen información y es su secuencia de amonoácidos, que determina la forma de la proteína y esta forma determina su función. Estas son funciones activas, que actúan y hacen cosas a diferencia de las funciones pasivas de polímeros de monómeros iguales.
Estas son funciones pasivas, no hacen nada, simplemente están ahí. Sin embargo, los polímeros de monómeros diferentes, como los ácidos nucleicos y las proteínas, tienen una propiedad extra y es que tienen la capacidad para hacer muchas cosas. Esto se debe a que están compuestos por monómeros diferentes, entonces sus moléculas tienen un orden, una secuencia que le permite contener una información y si se corta y se vuelve a unir, la molécula ya no es la misma, por lo tanto, ya no contiene la misma información. Los ácidos nucleicos tienen la información genética y esta es una secuencia de nucleótidos. Las proteínas también tienen información y es su secuencia de amonoácidos, que determina la forma de la proteína y esta forma determina su función. Estas son funciones activas, que actúan y hacen cosas a diferencia de las funciones pasivas de polímeros de monómeros iguales.
4. EL AGUA
Es la principal molécula de los seres vivos, ya que es el 70% de su peso, aunque depende del organismo, de la edad, de la parte del organismo... (semilla 10%, huesos 25%...) Lo más característico del agua es su estructura química, que nos permite entender todas las funciones de los seres vivos. Se representa como una molécula neutral, construida mediante enlaces covalentes donde los electrones se comparten (ni se pierden ni se ganan). No tienen carga eléctrica entonces son apolares. En las moléculas polares se ganan o pierden electrones. La molécula de agua es apolar, aunque el hidrógeno y el oxígeno tienen diferente electronegatividad, que es la afinidad por los electrones que tiene un elemento. El oxígeno es muy electronegativo, mientras que el hidrógeno es electropositivo. En el enlace covalente los electrones suelen estar a la misma distancia de los átomos que lo comparten. En el caso del agua, por su electronegatividad diferente, el oxígeno atrae con más fuerza a los electrones con lo cual están más cerca de él y más lejos del hidrógeno, de manera que está asimétrica distribuidos.
 Aunque se representa como una molécula electrónicamente neutra, tiene cierta carga negativa en la parte del oxígeno porque aumenta su densidad de electrones por su electronegatividad y por consiguiente, el hidrógeno adquiere cierta carga positiva porque los electrones están más alejados de él. Este es el denominado dipolo del agua
Aunque se representa como una molécula electrónicamente neutra, tiene cierta carga negativa en la parte del oxígeno porque aumenta su densidad de electrones por su electronegatividad y por consiguiente, el hidrógeno adquiere cierta carga positiva porque los electrones están más alejados de él. Este es el denominado dipolo del agua Veremos que todas las propiedades vitales del agua se dan, más que al propio dipolo, a la consecuencia que conlleva cuando dos moléculas de agua se encuentran, ya que se unen mediante un enlace denominado puente de hidrógeno. Este enlace se establece entre un átomo cargado negativamente con otro cargado positivamente. Las moléculas de agua no están aisladas, sino que se encuentran unidas mediante este enlace independientemente del número de moléculas que sean formando tetraedros. Estos enlaces por puentes de hidrógeno en estado líquido no son permanentes, sino que se forman y se destruyen continuamente durando cada enlace una millonésima de segundo. Son débiles por tanto, pero es el enlace más fuerte de los débiles.
Veremos que todas las propiedades vitales del agua se dan, más que al propio dipolo, a la consecuencia que conlleva cuando dos moléculas de agua se encuentran, ya que se unen mediante un enlace denominado puente de hidrógeno. Este enlace se establece entre un átomo cargado negativamente con otro cargado positivamente. Las moléculas de agua no están aisladas, sino que se encuentran unidas mediante este enlace independientemente del número de moléculas que sean formando tetraedros. Estos enlaces por puentes de hidrógeno en estado líquido no son permanentes, sino que se forman y se destruyen continuamente durando cada enlace una millonésima de segundo. Son débiles por tanto, pero es el enlace más fuerte de los débiles.4.1 Propiedades del agua y funciones biológicas
Las propiedades del agua son propiedades anómalas, es decir, extraordinariamente anormales a diferencia de otras moléculas:
1.- Calor específico: Cantidad de calor que hay que darle a una sustancia para aumentar 1ºC. El agua tiene un alto calor específico, con lo cual se le da mucho calor y aumenta poco su temperatura. Esto es debido a los puentes de hidrógeno y al dipolo. La temperatura es una medida de la energía térmica. Ésta agita a las moléculas, con lo cual es una medida de la agitación de las moléculas.Para que las moléculas de agua se agiten primero hay que romper los puentes de hidrógeno, de manera que parte del calor que se le da al agua se encarga de romper estos enlaces y esto permite mantener el calor sin aumentar su temperatura.
 Gracias a esto, el agua amortigua los cambios de temperatura, y esto es vital para los seres vivos porque el agua forma nuestro medio interno donde se desarrollan múltiples reacciones químicas mediante el metabolismo, que es un conjunto de reacciones químicas, de las cuales muchas realizan intercambios de energía. Si no tuviéramos agua, el metabolismo nos elevaría la temperatura. Esto es importante para los homeotermos (organismos de sangre caliente). Además influye en el clima de la Tierra, que es como es gracias al agua. De modo que amortigua los cambios de temperatura y de termina el clima por influencia marina.
Gracias a esto, el agua amortigua los cambios de temperatura, y esto es vital para los seres vivos porque el agua forma nuestro medio interno donde se desarrollan múltiples reacciones químicas mediante el metabolismo, que es un conjunto de reacciones químicas, de las cuales muchas realizan intercambios de energía. Si no tuviéramos agua, el metabolismo nos elevaría la temperatura. Esto es importante para los homeotermos (organismos de sangre caliente). Además influye en el clima de la Tierra, que es como es gracias al agua. De modo que amortigua los cambios de temperatura y de termina el clima por influencia marina.
2.- Calor de vaporización: Tiene un alto calor de evaporación, del orden de 500 veces el calor específico. La evaporación consiste en meterle calor a un líquido. Este calor agita las partículas hasta que el líquido adquiere un calor de evaporación que cuando supera la presión atmosférica se evapora. (= presión de vapor)
Pero todo el calor del agua no es para agitar sus moléculas, sino antes se debe romper los puentes de hidrógeno.
Esto tiene una utilidad para los seres vivos, y es que nos permite el enfriamiento por evaporación (transpiración). En las plantas, permite la ascensión de la savia bruta por capilaridad.
 Cuando está en estado líquido los puentes de hidrógeno se forman y se destruyen continuamente, pero cuando el agua es sólida los enlaces entre las moléculas de agua se hacen permanentes (baja agitación térmica) y en el centro de esos tetraedros se queda aire. Por eso tiene más volumen en estado sólido y una densidad más baja.
Cuando está en estado líquido los puentes de hidrógeno se forman y se destruyen continuamente, pero cuando el agua es sólida los enlaces entre las moléculas de agua se hacen permanentes (baja agitación térmica) y en el centro de esos tetraedros se queda aire. Por eso tiene más volumen en estado sólido y una densidad más baja.El hielo flota sobre el agua, por eso el fondo del mar no se congela, de manera que permite la vida en mares fríos.
4.- La tensión superficial alta: Es la oposición que presenta la superficie de un líquido a la introducción de un sólido. Es tan alta que una aguja si se coloca correctamente, flota. Esto es llamativo porque para que un cuerpo flote tiene que tener un volumen mayor que su peso. Sin embargo, la aguja tiene siete veces más su peso que su volumen. La tensión superficial es una medida de cohesión entre los enlaces de las moléculas en estado líquido.
 El dipolo y los puentes de hidrógeno permiten esta propiedad. Como consecuencia para los seres vivos, aprovechamos esta propiedad para producir movimientos celulares o la ascensión de la savia bruta por capilaridad.
El dipolo y los puentes de hidrógeno permiten esta propiedad. Como consecuencia para los seres vivos, aprovechamos esta propiedad para producir movimientos celulares o la ascensión de la savia bruta por capilaridad.5.- Disolvente universal de sustancias polares (con carga): Es el mayor disolvente debido al dipolo. Tiene cargas eléctricas entonces cuando está en presencia de otra sustancia con carga eléctrica, como el cloruro de sodio (+NaCl-), las cargas negativas del agua rodean al Na+ y las cargas positivas del agua rodean al Cl-. Como consecuencia, rompe el enlace iónico aislando las cargas eléctricas y disolviendo el compuesto. Para los seres vivos, esta propiedad hace que el medio interno de los seres vivos sea agua porque las moléculas orgánicas son sustancias polares. También sirve como medio de transporte gratuito de sustancias polares. (Difusión).
Las sustancias apolares cuando están en presencia de agua, huyen de ella por lo tanto determina la forma de las sustancias apolares porque éstas la evitan.
Todas estas propiedades lo son por el dipolo ya que en sí, el agua no hace nada, lo hace por sus características, es decir, son funciones pasivas. Pero también tiene funciones tan activas como para intervenir en las reacciones químicas del metabolismo, como en la hidratación, en la hidrólisis, en las reacciones químicas redox, en la fotosíntesis, para sintetizar ácidos grasos...
4.2 Disoluciones y dispersiones acuosas
El agua es la mayor parte del medio interno de los seres vivos. El medio interno está compuesto por el hialoplasma, que es el líquido acuoso del interior de la célula, el plasma sanguíneo, plasma intercelular y la linfa.

Se pueden dar diferentes situaciones en el medio interno, pero siempre es el agua el que predomina además de otras sustancias. Según estas sustancias, se dan tres tipos de situaciones:
1.- El agua más una sustancia polar, soluble y de un diámetro pequeño forma una disolución. Por ejemplo, el agua (disolvente) con el cloruro de sodio (Soluto).
2.- El agua más una sustancia insoluble y de diámetro grande forma una suspensión que sedimenta. Por ejemplo, el agua y la arena.
3.- El agua más una sustancia insoluble no apolar, cuyo diámetro es tan grande que no le permite formar una disolución, de manera que se mezclan pero no llega al punto de formar una disolución perfecta ni tampoco sedimenta. Esto es una dispensión acuosa.
Es lo que más se parece al medio interno. Dispone de una fase dispersante, y una fase dispersa. Si son tan pesadas, ¿por qué no sedimentan? Porque la agitación térmica del agua es suficiente para impedirlo, de modo que no caen. Además, generalmente, tienen cargas del mismo signo, entonces se repelen por repulsión eléctrica, de manera que no se unen y por lo tanto no sedimentan. Son turbias porque la fase dispersa se dispersa homogéneamente. Hay muchos tipos de dispersiones dependiendo de la fase dispersa y la fase dispersante. Se dan tres tipos de situaciones:
 Aerosoles: Es una dispersión de aire con un líquido o un sólido. Por ejemplo, el humo (partículas sólidas dispersas en el aire), la niebla, las nubes...
Aerosoles: Es una dispersión de aire con un líquido o un sólido. Por ejemplo, el humo (partículas sólidas dispersas en el aire), la niebla, las nubes...
La fase dispersante es el agua con un sólido: Si predomina el sólido se llama gel, como el queso, el flan, la gelatina... Si predomina el líquido se llama sol. El sol es lo que más se parece al medio interno (hialoplasma).

Dispersión de dos líquidos inmiscibles (no se mezclan): Ocurre gracias a una sustancia emulsionante. Por ejemplo, el agua y el aceite. Si le echamos jabón , cada gota de aceite rodea a una gota de jabón y la dispersión se hace estable. La bilis estabiliza las grasas en la digestión y el agua y la grasa, como en la leche, se mantiene unida gracias a la laseina de la leche (proteína) que es una sustancia emulsionante.
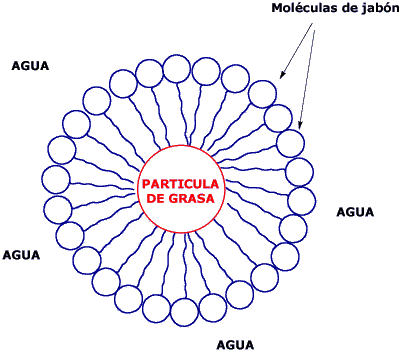
En cuanto hay una solución o una dispersión las propiedades del agua pura ya no son las mismas, ya que cambian propiedades como el calor de evaporación. Todas estas situaciones que se dan en el agua son vitales para los seres vivos, aunque en realidad lo que es vital es mantener la constancia de las variables de este medio interno, la homeostasis. A un mayor control del medio interno, más independencia del medio externo y más evolución.
4.3 Ósmosis y presión osmótica
Desde el momento en el que se pone una solución o una dispersión aparece un movimiento del soluto y del disolvente hasta que se igualan las concentraciones. Esta es la difusión, una ley del universo útil para los seres vivos, ya que proporciona un transporte gratuito. Lo que empuja a las moléculas hasta que se igualan las concentraciones es la presión osmótica, que es igual a la concentración del soluto.
 Un caso especial de difusión que sirve como forma de visualizar la presión osmótica es lo que ocurre cuando en una disolución o dispersión de diferentes concentraciones se separa por una membrana semipermeable, como la membrana plasmática o el celofán, caracterizada por permitir el paso solamente al disolvente y no al soluto, donde el disolvente, en vasos comunicantes, pasa al lado de mayor concentración. El agua (disolvente) pasa hasta que la presión hidroestática (peso de la columna de agua) se iguala con la presión osmótica. Son procesos naturales y repercuten a los seres vivos. Si esto ocurre en una célula, o explota o se arruga por el choque osmótico, lo que conllevaría a su muerte. De manera que no pueden soportar el choque osmótico continuamente, por eso hay que mantener constante la presión osmótica de la célula y el medio (homeostasis).
Un caso especial de difusión que sirve como forma de visualizar la presión osmótica es lo que ocurre cuando en una disolución o dispersión de diferentes concentraciones se separa por una membrana semipermeable, como la membrana plasmática o el celofán, caracterizada por permitir el paso solamente al disolvente y no al soluto, donde el disolvente, en vasos comunicantes, pasa al lado de mayor concentración. El agua (disolvente) pasa hasta que la presión hidroestática (peso de la columna de agua) se iguala con la presión osmótica. Son procesos naturales y repercuten a los seres vivos. Si esto ocurre en una célula, o explota o se arruga por el choque osmótico, lo que conllevaría a su muerte. De manera que no pueden soportar el choque osmótico continuamente, por eso hay que mantener constante la presión osmótica de la célula y el medio (homeostasis).
4.4 Producto iónico del agua. Escala del PH.
La máxima basicidad es aquella que tiene 10 elevado a -13 cargas negativas y 10 elevado a -1 cargas positivas y a su vez, también sería la mínima acidez.
Es incómodo utilizar potencias negativas, entonces para facilitar esto se utiliza el concepto del PH, que igual al

4.3 Ósmosis y presión osmótica
Desde el momento en el que se pone una solución o una dispersión aparece un movimiento del soluto y del disolvente hasta que se igualan las concentraciones. Esta es la difusión, una ley del universo útil para los seres vivos, ya que proporciona un transporte gratuito. Lo que empuja a las moléculas hasta que se igualan las concentraciones es la presión osmótica, que es igual a la concentración del soluto.
 Un caso especial de difusión que sirve como forma de visualizar la presión osmótica es lo que ocurre cuando en una disolución o dispersión de diferentes concentraciones se separa por una membrana semipermeable, como la membrana plasmática o el celofán, caracterizada por permitir el paso solamente al disolvente y no al soluto, donde el disolvente, en vasos comunicantes, pasa al lado de mayor concentración. El agua (disolvente) pasa hasta que la presión hidroestática (peso de la columna de agua) se iguala con la presión osmótica. Son procesos naturales y repercuten a los seres vivos. Si esto ocurre en una célula, o explota o se arruga por el choque osmótico, lo que conllevaría a su muerte. De manera que no pueden soportar el choque osmótico continuamente, por eso hay que mantener constante la presión osmótica de la célula y el medio (homeostasis).
Un caso especial de difusión que sirve como forma de visualizar la presión osmótica es lo que ocurre cuando en una disolución o dispersión de diferentes concentraciones se separa por una membrana semipermeable, como la membrana plasmática o el celofán, caracterizada por permitir el paso solamente al disolvente y no al soluto, donde el disolvente, en vasos comunicantes, pasa al lado de mayor concentración. El agua (disolvente) pasa hasta que la presión hidroestática (peso de la columna de agua) se iguala con la presión osmótica. Son procesos naturales y repercuten a los seres vivos. Si esto ocurre en una célula, o explota o se arruga por el choque osmótico, lo que conllevaría a su muerte. De manera que no pueden soportar el choque osmótico continuamente, por eso hay que mantener constante la presión osmótica de la célula y el medio (homeostasis).4.4 Producto iónico del agua. Escala del PH.
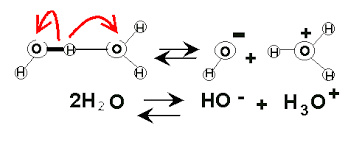
El agua forma enlaces covalentes, de manera que aunque tenga dipolos se considera neutra. Sin embargo es una molécula que se ioniza, es decir, que gana y pierde electrones débilmente, tanto que sólo se ioniza 1 de cada 550 millones de moléculas de agua.
Resulta que la fuerza de los puentes de hidrógeno es suficiente para que esta molécula capture a un protón, de modo que:
Cuando el agua es pura a 25ºC, es decir, cuando esta reacción está en equilibrio, resulta que el número de cargas positivas por el número de cargas negativas es igual a 10 elevado a -14. Se convierte, entonces, en una constante, donde el número de cargas positivas y el número de cargas negativas son inversamente proporcionales.
El 10 elevado a -7 se considera la neutralidad y se utiliza como referencia para saber si una sustancia es ácida o es básica, es decir, para medir la acidez o la basicidad de las disoluciones. Si tiene más cargas positivas es ácida y si tiene más cargas negativas es básica. De manera que la máxima acidez es aquella que tiene 10 elevado a -13 cargas positivas y 10 elevado a -1 cargas negativas y a su vez, también sería la mínima basicidad.La máxima basicidad es aquella que tiene 10 elevado a -13 cargas negativas y 10 elevado a -1 cargas positivas y a su vez, también sería la mínima acidez.
Es incómodo utilizar potencias negativas, entonces para facilitar esto se utiliza el concepto del PH, que igual al
-lg |H+|
Por ejemplo, -lg|10 e. -3| = 3 dando así un número entero. Entre un nivel de PH y otro, hay una variación de 10 cargas. De manera que si subes en la escala hay más cargas negativas y menos cargas positivas, siempre actuando en proporción. Esto es imprescindible para los seres vivos.
Una sustancia es ácida cuando suelta cargas positivas puesta en disolución, mientras que una sustancia básica suelta cargas negativas en disolución. Todas las bases sueltan cargas negativas, excepto las bases del nitrógeno, como el NH2, que lo que hace es capturar cargas positivas y no suelta cargas negativas. Estas son muchas bases orgánicas. El número de cargas que suelta un ácido o una base depende de que sea fuerte o débil. Las fuertes sueltan muchas cargas mientras que las débiles no tanto. Esto está cuantificado por la llamada constante de disociación. (disociado/sin disociar)

En los ácidos o bases fuertes existe una constante de disociación alta, mientras que en los débil la constante de disociación es baja. Cuando se pone en disolución un ácido fuerte o una base fuerte, inmediatamente se disocia. Esto quiere decir que tiene la misma cantidad de forma disociada que sin disociar.
Cuando un ácido o una base está disociado, tiene carga eléctrica. Los débiles en disolución no se disocian instantáneamente, con lo cual no podemos decir con certeza si tiene carga o no. Estas bases o ácidos débiles son los que tenemos los seres vivos, que tiene como característica la constante de disolución baja y no sabemos si tiene carga eléctrica o no, entonces para averiguarlo se utiliza otro concepto llamado PK. El PK es aquel valor de PH en la que el ácido o base débil está mitad disociado y mitad sin disociar, es decir, a qué valor del PH en el que el ácido o base débil se comporta como un ácido o base fuerte, es decir, saber si tiene carga eléctrica. Para decirlo de otra manera, es el PH al que se comporta un ácido o una base débil como si fuera fuerte, que quiere decir que tiene carga eléctrica.
¿Y para qué saber si tiene carga o no? Es importante porque durante el metabolismo continuamente se producen H+ y HO- (cargas). Las cargas positivas bajan el PH y las negativas suben el PH. Si cambia el PH se pierden cargas deseables o se ganan cargas indeseables, de manera que se aleja del PK deseable. Esto tiene consecuencias:
En las proteínas hay muchos ácidos y bases débiles. Sus cargas eléctricas determinan la forma de la proteína y ésta su función. Si cambia las cargas eléctricas, cambia la forma y la función y esto no se puede permitir, con lo cual, no soportamos cambios de PH de unas décimas sobre la neutralización. Para evitar este cambio del PH, existe una homeostasis a través de "sistemas tampón", que son un conjunto de sustancias que capturan las cargas eléctricas (H+/OH-) para evitar los cambios en el PH.
5. SALES MINERALES
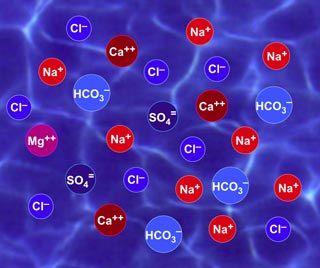 Una sal es la unión de un ácido(-) más una base(+) mediante un enlace iónico. Cuando una sal entra en disolución obtenemos sus iones. (HCO3-, CL-, H2PO4-, HPO4--, NA+, K+, Mg++, Ca++...)
Una sal es la unión de un ácido(-) más una base(+) mediante un enlace iónico. Cuando una sal entra en disolución obtenemos sus iones. (HCO3-, CL-, H2PO4-, HPO4--, NA+, K+, Mg++, Ca++...)
Estos iones los tenemos por sus propiedades y por las funciones biológicas que realizan. Hay dos tipos de funciones:
- Específicas: Como el fosfato cálcico que forma los huesos o el Na+/K+ que son responsables del impulso nervioso.
- Generales (comunes a todas las sales): Se debe a su naturaleza y a sus propiedades químicas, que son las que utilizamos los seres vivos para establecer la homeostasis, que mantiene el equilibrio de algunas variables físico-químicas del medio interno.
5.1 Propiedades de las sales minerales
1) Regulación de equilibrios osmóticos: Las células se arrugan en un medio hipertónico y se hinchan en un medio hipotónico (plasmólisis en animal donde puede explotar y morir, o turgencia en vegetal, donde se hincha pero no explota). Durante el metabolismo cambia la presión osmótica del medio, y para evitarlo existe la homeostasis para mantener un medio isotónico. Lo hace mediante sales porque son solubles y crean presión osmótica. Las células cogen sales cuando hay un medio hipertónico para estar en equilibrio.
2) Regulación del equilibrio ácido/base por la propiedad de ser las sales un ácido y una base: Necesitamos un PH neutro (fisiológico) pero durante el metabolismo el PH sube y baja. Esto no se puede permitir porque sólo soportamos algunas décimas por encima del PH neutro porque afecta a las cargas de las proteínas... etc. Entonces se controla mediante el efecto tampón. Este efecto consiste en un par de sustancias las cuales una de ellas sirve para hacer cambios ácidos y la otra para hacer cambios básicos. Se suma el ácido o la base débil más su sal correspondiente. Nuestro PH interior tiende a hacerse más ácido, así que la mayoría son tampones para utilizarlos en cambios ácidos.
Por ejemplo, si disociamos HCl quedaría H+ y Cl- y como consecuencia bajaría el PH. Pero no llega a bajar porque el NaHCO3 se disocia y da lugar a HCO3- y Na+. Si sumamos ambas disoluciones, el H+ del HCl se úne con el HCO3- del NaHCO3 formando H2CO3 y el Cl- del HCl se úne con el Na+ del NaHco3, formando NaCl. De esta manera la disolución queda neutra y sin ninguna carga de más ni de menos.
Otro tampón es el H2PO4 y el CaHPO4 para cambios ácidos.
3) Mantenimiento de equilibrios eléctricos: Lo hace en forma de iones y como son iones actúan en el establecimiento y mantenimiento de los equilibrios eléctricos, por ejemplo en el sistema nervioso y en la contracción de los músculos por sus propiedades vitales que los seres vivos necesitamos.
5. SALES MINERALES
 Una sal es la unión de un ácido(-) más una base(+) mediante un enlace iónico. Cuando una sal entra en disolución obtenemos sus iones. (HCO3-, CL-, H2PO4-, HPO4--, NA+, K+, Mg++, Ca++...)
Una sal es la unión de un ácido(-) más una base(+) mediante un enlace iónico. Cuando una sal entra en disolución obtenemos sus iones. (HCO3-, CL-, H2PO4-, HPO4--, NA+, K+, Mg++, Ca++...)Estos iones los tenemos por sus propiedades y por las funciones biológicas que realizan. Hay dos tipos de funciones:
- Específicas: Como el fosfato cálcico que forma los huesos o el Na+/K+ que son responsables del impulso nervioso.
- Generales (comunes a todas las sales): Se debe a su naturaleza y a sus propiedades químicas, que son las que utilizamos los seres vivos para establecer la homeostasis, que mantiene el equilibrio de algunas variables físico-químicas del medio interno.
5.1 Propiedades de las sales minerales
1) Regulación de equilibrios osmóticos: Las células se arrugan en un medio hipertónico y se hinchan en un medio hipotónico (plasmólisis en animal donde puede explotar y morir, o turgencia en vegetal, donde se hincha pero no explota). Durante el metabolismo cambia la presión osmótica del medio, y para evitarlo existe la homeostasis para mantener un medio isotónico. Lo hace mediante sales porque son solubles y crean presión osmótica. Las células cogen sales cuando hay un medio hipertónico para estar en equilibrio.
2) Regulación del equilibrio ácido/base por la propiedad de ser las sales un ácido y una base: Necesitamos un PH neutro (fisiológico) pero durante el metabolismo el PH sube y baja. Esto no se puede permitir porque sólo soportamos algunas décimas por encima del PH neutro porque afecta a las cargas de las proteínas... etc. Entonces se controla mediante el efecto tampón. Este efecto consiste en un par de sustancias las cuales una de ellas sirve para hacer cambios ácidos y la otra para hacer cambios básicos. Se suma el ácido o la base débil más su sal correspondiente. Nuestro PH interior tiende a hacerse más ácido, así que la mayoría son tampones para utilizarlos en cambios ácidos.
Por ejemplo, si disociamos HCl quedaría H+ y Cl- y como consecuencia bajaría el PH. Pero no llega a bajar porque el NaHCO3 se disocia y da lugar a HCO3- y Na+. Si sumamos ambas disoluciones, el H+ del HCl se úne con el HCO3- del NaHCO3 formando H2CO3 y el Cl- del HCl se úne con el Na+ del NaHco3, formando NaCl. De esta manera la disolución queda neutra y sin ninguna carga de más ni de menos.
Otro tampón es el H2PO4 y el CaHPO4 para cambios ácidos.
3) Mantenimiento de equilibrios eléctricos: Lo hace en forma de iones y como son iones actúan en el establecimiento y mantenimiento de los equilibrios eléctricos, por ejemplo en el sistema nervioso y en la contracción de los músculos por sus propiedades vitales que los seres vivos necesitamos.




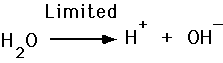


No hay comentarios:
Publicar un comentario