- Son el 50% del peso seco en los seres vivos y cumplen muchas funciones pero no actúan como fuente de energía.
- Tienen actividad vital a diferencia de los lípidos y glúcidos. Esa actividad vital se encuentra en que son polímeros de monómeros distintos, de modo que tienen una secuencia, un orden que constituye la información sobre su forma.
- La forma de la proteína determina su función. Son polímeros lineales de aminoácidos en un número muy elevado (10e.3). Forman macromoléculas, de modo que son extraordinariamente complejas. Se montan y desmontan fácil y constantemente, lo cual nos explica la regeneración constante.
- Cuando se coge una proteína, sus enlaces se rompen por hidrólisis. Cuando hidrolizas una proteína (bajando el PH, subiendo la temperatura, echándole sal o detergente...) vemos que está formada por polipéptidos y, si hacemos más intensa la hidrólisis, los polipéptidos se rompen en 20 aminoácidos distintos.
1. Aminoácidos
Se llaman así porque tienen un grupo amino C-NH2 y un grupo ácido -COOH. Se diferencian en el resto.
1.1 Propiedades de los aminoácidos
- Tienen un carácter ácido/básico porque tienen un grupo ácido y otro básico (débil). Se comportan como ácidos(desprende cargas positivas) a un PH básico y como básicos(desprenden cargas negativas) a un PH ácido. Para entender esto hay que hacer una curva de titulación, por ejemplo, de alamina. Para ello hay que conocer sus valores de PK (mitad disociado, mitad sin disociar), donde el grupo ácido tiene un PK=2,3 y el grupo básico tiene un PK= 9,69.

- Son determinantes en la forma de la proteína
- Son moléculas polares, solubles en agua y cristalizan. Tienen alto punto de fusión.
- Presentan isomería espacial al igual que los monosacáridos debida a tener carbonos asimétricos. Uno no tiene carbono asimétrico, es la gricocola, que no tiene isomería espacial. Quien decide si es D o L según esté situado es el NH2. Son más frecuentes los L-Aa, con el grupo amino a la izquierda.
- Tienen actividad óptica. (isomería óptica)
1.2 Clasificación de los aminoácidos
Se clasifican según se encuentre el aminoácido a PH6. Existen cuatro tipos:
- Apolares: Como la prolína. Su grupo amino ciclado repercute en los ph.
- Polares sin carga
- Polares con carga.
1.3 Enlace peptídico
Enlace de unión de los aminoácidos.
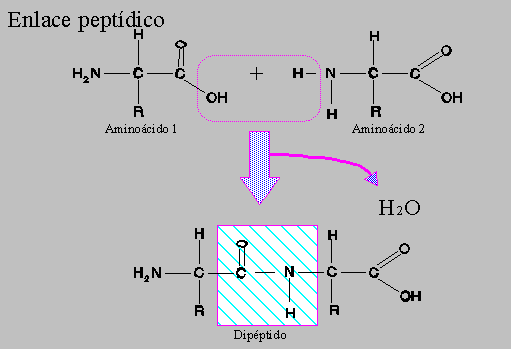
Se produce entre el grupo ácido del primer aminoácido y el grupo amino del segundo aminoácido. Se desprende una molécula de agua para romper el enlace mediante hidrólisis.
Tiene una característica, y es que es un enlace resonante, donde tiene parte sencillo y parte doble. Esto tiene una consecuencia y es que como el enlace puede estar de maneras diferentes, los cuatro átomos (átomos peptídicos) comparten electrones entre todos ellos, y esto obliga a que siempre tengan que estar en el mismo plano, es decir, no pueden girar, de modo que tienen consecuencias importantes, las demás sí pueden girar, pero el más importantes es el giro del carbono alfa porque determina la estructura de la proteína y determina el resto que va unido. Se forma una línea quebrada formada por carbono alfa y átomos peptídicos. Los restos quedan alternados arriba y abajo en torno a la línea quebrada.

1.4 Estructura de las proteínas
Dos aminoácidos unidos por un enlace peptídico es un dipétido hasta más de 10 aminoácidos de llama polipétido. Una proteína son uno o más polipéptidos. Cada proteína está formada por amonoácidos colocados en un cierto orden (siempre el mismo). Los amonoácidos de las proteínas y el orden se conoce como secuencia, y esto constituye la estructura primaria de la proteína (línea quebrada más los átomos peptídicos) Aa1 - Aa2 - Aa3 - Aa4...
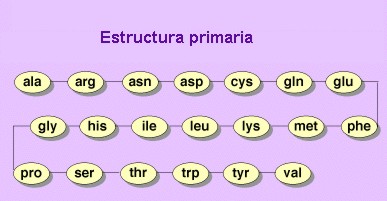
La estructura primaria determina las demás estructuras de esa proteína, es decir, su forma y su funcionamiento. También determina sus propiedades, por ejemplo, la especifidad: La misma proteína (hemoglobina) la tiene los seres vivos pero se diferencian en la estructura primaria.
No cambia cualquiera de sus aminoácidos, porque hay unos aminoácidos esenciales que no cambian nunca que son para realizar las funciones de la insulina, que cambian los aminoácidos que no son esenciales.
La estructura primaria, cuando se conoció, se pensó que si era extendida y alargada, pues se supuso que las proteínas serían extendidas y no existían más estructuras. Se concluyó lo contrario por la difracción de rayos X con proteínas en disolución. Se comprobó que no eran extendidas, sino que tenían muchas más estructuras, eran estructuradas y formaban el estado dativo, donde tiene más baja energía y es más estable por poseer más enlaces, o sea, toma su forma.
Se encontró una estructura secundaria, que es el resultado del giro del carbono alfa en la estructura primaria. Tiene tres tipos:
- Alfa- hélice: Aparece cuando el carbono alfa en la línea quebrada gira helocoidalmente en torno a un eje imaginario con 3,6 aminoácidos por vuelta. (ADN) porque quedan enfrentados en la posición geométrica adecuada (distancia entre ellas y orientación adecuada) para formar los puentes de hidrógeno entre los enlaces peptídicos que estabilizan la estructura. Los restos del aminoácido quedan hacia fuera. Estos puentes de hidrógeno tienen la característica de que están dentro de la cadena.

- Beta- hoja plegada: Los carbonos alfa actúan, dentro de la línea quebrada de la estructura primaria, como puntos de plegamiento. Se mantiene por los átomos peptídicos de dos cadenas paralelas. Quedan en la posición geométrica correcta para formar puentes de hidrógeno.

- Triple hélice: Como la del colágeno. Es una proteína muy frecuente en los músculos. Presenta una triple hélice porque en su estructura primaria tiene gran cantidad de aminoácidos, que son la prolina y la hidroxiprolina. La prolina tiene su grupo amino ciclado y solamente tiene un hidrógeno porque el segundo enlace lo tiene dentro del anillo, de modo que no tienen hidrógeno suficiente parea hacer los puentes de hidrógeno, por eso no puede formar alfa-hélice, entonces hace la triple hélice, que son tres hélices muy extendidas entre las que se mantienen unidas por puentes de hidrógeno intercaternarios.

Ninguna proteína está completamente estructurada, ni presenta un solo tipo de estructura secundaria, de modo que pueden presentar discontinuidades.
El conjunto de las estructuras secundarias y sus discontinuidades forman la estructura terciaria, el estado dativo. También va a ser determinada por la estructura primarias.
Las causas de estas discontinuidades son varias:
- Cuando una proteína tiene entre sus aminoácidos la prolina e hidroxiprolina produce discontinuidades porque en la estructura alfa-hélice y beta-hoja plegada tiene incapacidad para formar los puentes de hidrógeno.
- Aminoácidos con restos apolares: Cuando en una proteína abundan estos aminoácidos con restos apolares, como son hidrófobos (lipófilos) y están rodeados de agua, los restos se meten dentro de la cadena huyendo del agua. Si estos restos se van hacia dentro, pues rompe la cadena y produce discontinuidades, especialmente si los aminoácidos son muy voluminosos.
- Aminoácidos con restos polares con carga.
4. Ocurre con la listeína. Cuando se enfrentan en la posición geométrica adecuada, forman un enlace por puentes de disulfuro.
La estructura terciaria se mantiene gracias a los nuevos enlaces que se forman entre aminoácidos próximos. (estado dativo)
Estos enlaces que mantienen la estructura terciaria son débiles y numerosos:
- Puentes de hidrógeno: Entre el hidrógeno y un átomo electronegativo cargado (N/O)
- Interacciones iónicas: Ocurre por la atracción eléctrica entre aminoácidos cargados de distinta carga próximos.
- Fuerzas de Van der Waals: Aminoácidos con resto como hidrocarburos y/o anillos próximos, donde hay muchos electrones compartidos, de modo que existen electrones con cierta libertad que pueden saltar de un enlace a otro provocando cargas eléctricas. Es un enlace electrostático pero a diferencia del enlace por puentes de hidrógeno y las interacciones iónicas, las cargas no son fijas, sino fluctuantes.
- Interacciones hidrofóbicas: Aminoácidos con restos apolares, donde el resto se introduce en las cadenas huyendo del agua por hidrofobia y dentro, tienen a reunirse entre ellos porque son lipófilas formando un enlace.
Todos los enlaces son débiles pero suficientemente numerosos como para hacer que la estructura terciaria permanezca. Además de los débiles hay uno fuerte: El enlace covalente que se establece entre la cisteína y los puentes de sulfuro enfrentados y próximos.
Estas son las estructuras de las proteínas sin subunidad, pero hay proteínas como la hemoglobina que tiene subunidades, de modo que cada subunidad tiene estructura terciaria.

El conjunto de las estructuras terciarias de sus sus subunidades es la estructura cuaternaria, lo que es el estado dativo. Se mantiene porque entre las estructuras terciarias se producen enlaces, todos débiles y numerosos y son los mismos que mantienen la estructura terciaria excepto los puentes de disulfuro.
La forma de una proteína, terciaria o cuaternaria, depende de los enlaces débiles que se alteran fácilmente cambiando su forma, lo que determina su funcionamiento. Precisamente, esta forma hace que ciertos restos queden en la superficie provocando que algunos de ellos interaccionen débilmente con un ligando, por ejemplo la enzima con el sustrato, los anticuerpos con los antígenos o la hemoglobina con el oxígeno.

Estas interacciones van a desembocar en la unión entre el ligando y la proteína, y como resultado de esta unión, otros restos de la proteína van a interaccionar débilmente con el ligando provocando la acción de la proteína.

Estos restos son esenciales, ya que son los aminoácidos de unión. Nunca cambian en ciertas proteínas. Pueden estar muy alejados unos de otros en la cadena, lo único que ocurre es que siempre aparecen reunidos en un surco en la superficie de la proteína como consecuencia de su estructura. Este surco es llamado centro activo cuya forma, que es consecuencia de la estructura de la proteína, permite reconocer al ligando por su forma. (Imagen anterior)
Además de estos aminoácidos esenciales, también son esenciales los que mantienen sus estructuras. Todos estos aminoácidos nunca cambian en la evolución y el resto de aminoácidos son de relleno, no son esenciales, no tienen ninguna función en la proteína, ya que si algunos cambian no alteran nada fundamental.
2. Propiedades de las proteínas.
- Solubilidad en agua, aunque no son perfectamente solubles, la mayoría son solubles porque 2/3 de los aminoácidos son polares con carga o sin carga, porque la mayoría de los aminoácidos de una proteína son polares, pero en sí son muy grandes, de modo que se forman dispersiones coloidales.(ver agua).
- Especificidad: De individuo y de especie. Varía la estructura primaria pero nunca cambian los aminoácidos esenciales. Nuestro sistema inmunitario conoce la estructura primaria de nuestras proteínas y a las extrañas las ataca. Esto produce el rechazo en los trasplantes Si la diferencia es un aminoácido esencial las consecuencias son grandes, es una enfermedad, como la anemia faciforme que altera la forma de los glóbulos rojos, ya que afecta a un aminoácido esencial. Como consecuencia capta menos oxígeno, ya que esos aminoácidos son destruidos por el bazo, porque reconoce que están en mal estado.
- Desnaturalización y renaturalización: La forma de una proteína depende del número de enlaces débiles que mantienen en la estructura secundaria, terciaria y cuaternaria (estado dativo que alcanzan espontáneamente), que dependen de sus aminoácidos. De modo que todas las estructuras dependen del orden, es de cir, de la estructura primaria, y siempre son enlaces débiles que pueden alterarse fácilmente, de modo que pierde el estado dativo, es decir, su forma y consecuentemente, su función.

De manera que se vuelve insoluble, cambia su estructura y consecuentemente, sus propiedades. Si lo volvemos a poner en condiciones adecuadas, vuelve a su estado dativo. Esto ocurre en una desnaturalización reversible, donde no cambia la estructura primaria. Si se aumenta más la temperatura, se rompe la estructura primaria y conseguimos trozos de la proteína, entonces ya no vuelve a su estado dativo, como ocurre con el huevo cuando lo freímos.
3. Clasificación y funciones biológicas de las proteínas.
Se pueden clasificar según distintos criterios.
- Por su composición química: Dos grupos:
- Holoproteínas: Formadas sólo por amonoácidos. Dentro, se clasifican según su forma:
- Globulares: Son albúminas y globulinas, responsables del transporte en sangre.
- Fibrosas: Miosina en músculos, queratina en la piel, pelos y uñas...
- Heteroproteínas: Formadas de aminoácidos más otras moléculas orgánicas distintas, llamadas grupo prostético unido covalentemente a la proteína (de forma definitiva). Este grupo es el que realiza la función de la proteína y los aminoácidos crean el ambiente adecuado para que ese grupo prostético funcione. Por su grupo prostético, se clasifican en:
- Glucoproteínas: G.P. es un glúcido.
- Fosfoproteínas: G.P. es un ácido ortofosfórico, como la yema del huevo.
- Nucleoproteínas: G.P. son lso ácidos nucléicos, como lso cromosomas, ribosomas, cromatina...
- Cromoproteínas: G.P. es un anillo tetrapirrólico, que tiene enlaces resonantes(en cualquier posición) Cuatro anillos forman un tetrapirrol, que se combinan con un metal.

- Por sus funciones biológicas: La mayoría de las funciones biológicas las realizan las proteínas, de modo que es más fácil clasificarlas por las funciones que no realizan. Lo único que no hacen es actuar como fuente de energía.
- Dedicadas al transporte: Hemoglobina, mioglobina, albúminas...
- Movimiento: Cilios, flagelos, actina y miosina...
- Defensa del organismo: Anticuerpos
- Catalizadores: Son los más abundantes. Aceleran las reacciones químicas del metabolismo. Enzimas
- Estructural: Membrana plasmática, queratina, colágeno...





muy interesante
ResponderEliminarY tanto ... jajaja
ResponderEliminar