A los seres vivos podemos considerarlos como unas máquinas que funcionan mediante reacciones químicas. Para que sirva, se necesita que las reacciones químicas ocurran a tiempo real ya que, por sí mismas, son lentas y si funcionaran así serían inútiles para los seres vivos, ya que irían por detrás de la realidad. Las enzimas aceleran las reacciones químicas del metabolismo para que el ser vivo pueda funcionar en tiempo real, de modo que actúan como catalizadores.
1. Mecanismos de acción enzimática.
Debemos repasar conceptos de la energética y cinética de las reacciones químicas. Una reacción química consiste en la rotura o formación de enlaces. Las del metabolismo son todas reversibles y , consiguientemente, se da un equilibrio.
La energía de activación es la mínima cantidad de energía necesaria para convertir un mol de sustrato en un mol de producto para romper o formar enlaces. Consiste en subir al sustrato al nivel de energía superior aumentándole la temperatura o aplicándole descargar eléctricas...

En los seres vivos no puede ser así, entonces actúa la enzima para disminuir la energía de activación y acelerar la reacción. Entre el sustrato y el producto hay un complejo intermedio, que es donde tiene mayor energía libre porque ha absorbido la energía de activación. Por su naturales, es inestable y los enlaces están medio rotos o/y medio formados, de modo que "tiende" (no necesariamente) a transformarse en producto.
Pero para que la reacción química realmente ocurra, además de la energía de activación, es necesario que se encuentre A y B, sino la reacción no puede ocurrir.
A + B <---> C
Además, deben colisionar de la única forma correcta, de una forma determinada. De modo que se tiene que dar una geometría de colisión. La enzima favorece la geometría de colisión y consecuentemente disminuye la energía de activación porque se ahorra la energía de la "prueba de colisiones", de modo que favorece el desarrollo de la reacción bajando su energía de activación y con menos energía se consigue mayor velocidad.

En cuanto a la velocidad de las reacciones químicas (e. cinética), depende de la energía de la reacción que es igual a la energía de los sustratos menos la energía de los productos. Si esa diferencia es positiva, la reacción tiende a ocurrir (exotérmica, desprende energía). Pero si es negativa, hace falta meterle más energía a esa reacción para que ocurra, de modo que es endotérmica (absorbe energía).
Si al energía de activación es muy pequeña entonces la reacción es espontánea porque basta la agitación térmica de la temperatura ambiente o de la luz.
Lo que hacen las enzimas es favorecer la geometría de colisión haciendo que toda la energía se invierta en formar el producto y el desarrollo de la reacción debilitando enlaces a romper o exponiendo grupos químicos a enlazar...
Al bajar la energía de activación hacen las reacciones espontáneas, de modo que aumenta la velocidad y actúan en bajas concentraciones interviniendo en la reacción pero recuperándose intactos, sin alterar el equilibrio de la reacción.
2. Características de la catálisis enzimática
- Complejo enzima - sustrato y centro activo: A las reacciones catalizadas por enzimas se les aplican la misma energética y cinética de las reacciones químicas en general, pero tienen una peculiaridad, que siempre se combinan con el sustrato formando el complejo enzima - sustrato.

Transforma el sustrato en producto y queda la enzima libre. Esta unión enzima - sustrato siempre ocurre en la superficie de la enzima y más exactamente en un surco en la superficie de la enzima que se llama centro activo, cuya forma permite a la enzima reconocer al sustrato por estereoespecifidad (formas que deben ser complementarias). Este "acoplamiento" espacial entre E-S aproxima a ciertos grupos químicos del sustrato a la enzima que van a conducir a la formación de enlaces débiles. De manera que el sustrato correcto será el que posea estos aminoácidos de unión además de tener la forma. Estos aminoácidos provocan la unión E-S pero, por efecto de esa unión, el sustrato también interacciona con otros aminoácidos del control activo, llamados aminoácidos catalíticos, que van a favorecer el desarrollo de la reacción debilitando un enlace a romper o exponiendo a un grupo químico a enlazar. Estos aminoácidos de unión y catalíticos son esenciales.
También existen otros aminoácidos esenciales, los que determinan la estructura de la proteína (enzima), de modo que mantienen el estado nativo, porque si cambia la forma de la enzima también cambia el centro activo y ya no ocurre la unión E-S. Esta unión cambia la forma de ambos (como la mano y el guante) que es necesario para el desarrollo de la reacción. Los aminoácidos de unión y catalíticos pueden estar muy alejados en la estructura primaria pero aparecen muy cerca en el surco de la superficie debido a los pliegues de la cadena.
- Especificidad de la acción enzimática: Las enzimas son estereoespecíficas con los sustratos. Puede ser total y ser capaces de distinguir incluso isómeros. Pero es más frecuente que la enzima del sustrato no sea total sino de grupo, que consiste en reconocer a ciertos grupos químicos en todos los seres vivos que lo posean. También tienen especificidad de acción, que consiste en que cierto aminoácido catalítico puede favorecer un tipo de reacción.
- Cofactores y vitaminas: Hay muchas enzimas que necesitan la ayuda de otras moléculas para realizar su funcionamiento, de modo que son necesarios. Se unen débil y temporalmente entre sí, pero no es un grupo prostético porque éste se encuentra permanentemente unido a la proteína. Los cofactores son iones metálicos, pero cuando son otras moléculas orgánicas se les llama coenzimas. Las enzimas intervienen en las reacciones químicas pero tienen que acabar intactos, de modo que las coenzimas actúan como aceptores temporales de grupos químicos movilizados por las propias enzimas. Son transportadores de grupos químicos entre una enzima que lo precisa y otra que lo cede.
Son nucleótidos y son esenciales, sin ellos no funcionan sus enzimas y podemos fabricarlas. El problema está en otros coenzimas, como la A que transporta ácido acético. Son sustancias que no podemos fabricar pero resultan imprescindibles y también son esenciales, de modo que tenemos que tomarlas en la dieta. Son las vitaminas.
Las vitaminas las necesitamos como coenzimas y siempre están asociadas a las enzimas que están en concentraciones pequeñísimas. Su déficit produce la falta de reacciones del metabolismo porque las enzimas no pueden funcionar sin ellas. Si hay ciertas reacciones del metabolismo que deberían de ocurrir y no ocurren, tenemos síntomas de avitaminosis y surgen enfermedades carenciales que desaparecen con la adición a la dieta. Las vitaminas se clasifican en:
- Hidrosolubles: No son tóxicas, como la vitamina C que se elimina a través de la orina. Funciona como coenzimas o grupo prostético.
- Liposolubles: Sí pueden ser tóxicas y no actúan ni como coenzimas ni grupos prostéticos.
- Mecanismo para aumentar la eficacia de las reacciones enzimáticas: sistemas multienzimáticos y compartimentación: Tienen otras características que permiten mejorar su eficacia, es decir, aumentar la velocidad. Un mecanismo es el que se consigue acoplando las reacciones metabólicas. La velocidad de las reacciones químicas tienen que ver con la cantidad del sustrato, de modo que si un sustrato es grande retrasa la velocidad de las reacciones. Por ello, se acoplan unas con otras y así se soluciona este problema. Además las enzimas están asociadas en un sistema multienzimáticos cuyas reacciones acopladas constituyen una secuencia de reacciones(células procariotas). Dentro de la célula, alcanzan grandes concentraciones de sustrato con pequeñas cantidades de sustrato porque ocurren en compartimentos, de modo que aumenta la velocidad de las reacciones sin disolverse en todo el hialoplasma. La compartimentación (en células eucariotas) permite realizar más funciones incompatibles en cada compartimento (orgánulos). Los sistemas multienzimáticos están asociados a las membranas de los orgánulos cuya secuencia discurre dentro de él, como en las mitocondrias (respiración celular) o en los cloroplastos (fotosíntesis)
- Cinética de las reacciones catalizadas por enzimas: Ecuación de Michaelis - Menten: Tiene la misma cinética que las reacciones químicas pero con una característica, y es que presentan saturación por sustrato.

En la primera fase (hasta 1/2 V máx.) la velocidad es directamente proporcional a la concentración de sustrato.
En la segunda fase (desde 1/2 V máx. hasta Vmáx.) sigue siendo proporcional pero no directamente V~|S|.
En la tercera fase (a partir de Vmáx.) por más sustrato que le eche, la velocidad no aumenta más, de modo que la enzima está ocupada, es decir, que es la velocidad máxima de reacción. La ecuación de Michaelis - Menten explica la cinética relacionando la velocidad de la reacción con la concentración de sustrato y con ciertas características de las enzimas, que son su Vmáx y su Km. La Km es la concentración de sustrato que se da cuando la velocidad de la reacción es la mitad de la Vmáx.
La Km también es la constante de equilibrio en la reacción enzimática. Si la Km es baja quiere decir que hace falta poca concentración de sustrato, de modo que es inversamente proporcional a la afinidad de la enzima por el sustrato y viceversa.
Cada enzima tiene su Vmáx y su Km, de modo que es característica de cada una y también varía con cada sustrato y con el PH, la temperatura y la concentración de coenzimas y cofactores. Esto nos lleva al concepto de valores ópticos, valores particulares de enzimas:
- Factores que influyen en la cinética de las reacciones enzimáticas
- |S| = V
- Temperatura óptima (37ºC) si |S| ~ V. Si la temperatura es menor, no se alcanza la energía de activación, entonces disminuye la velocidad. La temperatura en los seres vivos es termolabil (se rompe con la agitación térmica) Esta agitación si es excesiva rompe la mayoría de los enlaces débiles de las proteínas, de modo que la velocidad de las reacciones disminuye y altera la forma catalíticamente activa del enzima, llegando a perder el estado nativo y la función que realizan. (V=0)
- PH óptimo (6,5 - 7): Depende de los PK de los grupos ionizantes de sus aminoácidos. (PK indica el grado de ionización que tiene una proteína a cierto PH) Una proteína tiene unas cargas deseables que forman los enlaces que determinan su forma (estado nativo de la proteína) además de los aminoácidos de unión y los catalíticos. Todas estas cargas no pueden cambiar, ni ellos ni sus cargas. Sus cargas cambian con el PH , de modo que el PH no puede cambiar.
- Coenzimas y cofactores: Estos son unos mecanismos de control de la velocidad inespecíficos, de modo que son inútiles para regular.
- Clasificación y nomenclatura de las enzimas: Se clasifican por la acción química que realizan: deshidrogenan, sintetizan, oxido reducen, deshidratan... Eso aparece en su nomenclatura.
3. Regulación de la acción o actividad enzimática
Existen parámetros generales que afectan a todas las enzimas como |S|, T, PH... que son inespecíficas e inútiles. Por otro lado, las necesidades celulares son cambiantes y el metabolismo se debe adaptar a esto, por economía celular y coordinación general. Esto se consigue con la activación/inhibición enzimática y las enzimas reguladoras, como alostéricos y modulados. Son capaces de cambiar en muy poco tiempo la intensidad del metabolismo.
La regulación es a nivel enzimática. Otra regulación es a nivel genético, teoría de Operón
3.1 Activación e inhibición enzimática
Hay factores activadores de la actividad enzimática, como la presencia del sustrato, de modo que si falta inhibe a la enzima hasta que no hay reacción.Hay un mecanismo más específico que es la utilización de inhibidores ("anticatalizador")
3.1.1 Inhibición enzimática: Se consigue mediante los inhibidores que disminuyen la velocidad de las reacciones. Se distinguen uno de otro experimentalmente por su efecto sobre la cinética:
- Inhibición competitiva: El inhibidor es químicamente semejante al sustrato, de modo que compite por el centro activo de la enzima. No da lugar a producto, por lo tanto la velocidad disminuye.

- Inhibición acompetitiva: El inhibidor no se parece al sustrato, sino que se une al complejo enzima - sustrato. Se dan dos reacciones, una que da producto y otra no, de modo que la velocidad disminuye.
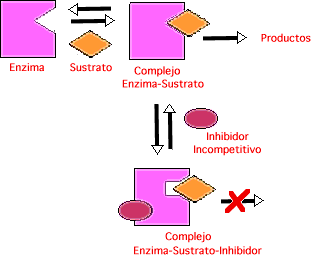
- Inhibición no competitiva: El inhibidor se combina tanto con el enzima libre como con el complejo E - S por un lugar distinto del centro activo. Se dan varias reacciones, y esto hace que disminuya la velocidad.
E+S <--> ES <--> E + P
E+I <--> EI <--> NO DA PRODUCTO
ES + I <--> ESI <--> NO DA PRODUCTO
Estas inhibiciones son las que se consideran verdaderas inhibiciones porque son reversibles. Existen otros tipos que son irreversibles:
- Inhibición irreversible: Lo hacen los insecticidas o el mercurio. Estas sustancias se combinan covalentemente (irreversiblemente) con aminoácidos esenciales del enzima alterándolo (el enzima no vuelve a reaccionar). A estas sustancias se les conoce como veneno metabólico.
3.2 Enzimas reguladoras
Tienen un papel fundamental en la regulación de la actividad enzimática. Hay algunos que tienen ese papel exclusivo. Son capaces de alterar en muy poco tiempo la intensidad del metabolismo. Son de dos tipos:
- Alostéricos: Tienen los enlaces de su centro activo en otro sitio, donde se vana unir unos moduladores que pueden ser positivos (que incrementa la velocidad) o negativos (que disminuye la velocidad) La caracterizan una cinética diferente al resto de las enzimas. A demás, su gráfica es sigmoidal porque parte del mismo sitio y llega al mismo sitio pero su "trayectoria" es diferente.

Pueden ser monovalentes (un solo modulador) o polivalentes (varios moduladores con varios centros alostéricos, uno para cada modulador) Los alostéricos se encuentran situados típicamente al comienzo de una secuencia de reacciones. Por ejemplo la secuencia de reacciones dentro de las células para convertir al aminoácido treamina en isoglucina. También, los alostéricos, se encuentran en encrucijadas metabólicas



No hay comentarios:
Publicar un comentario